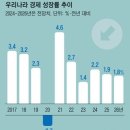
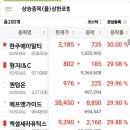
카페검색 본문
카페글 본문
-
HLB]엘레바, 美전역 영업·마케팅망 구축 착수…FDA 허가 자신 2025.01.12해당카페글 미리보기
수준으로 추정된다. 엘레바는 지난해 이와 유사한 인력 규모의 마케팅 및 영업 인력을 채용했으나 미국 식품의약국(FDA)으로부터 보완 요구를 받아 허가 절차가 지연되자 모두 해고 처리한 바 있다. FDA의 허가 승인 결정일(PDUFA)이 3월20일로 임박하면서...
-
HLB 그룹주 간암신약 허가심사 재개를 위한 美 FDA와 공장실사 보완 미팅 완료 2024.07.03해당카페글 미리보기
과의 미팅이 2일(미국시간) 완료됐다고 밝힘. HLB의 미국 자회사 엘레바와 항서제약이 참여한 가운데 이날 열린 미팅에서 FDA는 보완요청서신(CRL) 발급으로 지연됐던 본심사를 다시 속행하기 위해 “재심사 신청서를 제출할 것을 강력히권고한다”는 입장...
-
FDA 벽 높았다 HLB 리보세라닙 신약허가 불발 기사 2024.05.17해당카페글 미리보기
벽 높았다"…HLB, ‘리보세라닙’ 신약허가 불발 HLB(028300)그룹의 간암 표적항암제 ‘리보세라닙’이 미국 식품의약국(FDA)으로부터 보완요구서한(CRL)을 받으며 신약 품목허가 여부 결정이 지연됐다. HLB그룹이 허가 신청에 재도전할 시점을 가늠 n...
-
FDA, LAMA2-CMD 치료제 MDL-101 희귀의약품 지위 획득 2024.10.30해당카페글 미리보기
치료제인 FDA의 희귀 소아 질환 지정을 받았습니다. "현재 미국에서는 라마2-CMD에 대해 승인된 치료법이 없습니다. 이 질병의 원인 유전자인 라마2의 자매 유전자인 라마1을 활성화하고 근본적인 치료법을 달성할 수 있는 잠재력을 가진 MDL-101이 이러한...
-
미국: FDA, PTSD 치료제로 환각성 MDMA 금지 2024.08.10해당카페글 미리보기
때 FDA가 신청을 거부할 것으로 예상했다. 하지만 Lykos는 회사와 다른 이해 관계자가 "자문 위원회 회의의 구조와 진행에 대해 우려를 표명했다"고 말했습니다. 여기에는 "패널의 주제 전문가 수가 제한적이고, 때때로 브리핑 문서의 과학적 내용을...
-
#빌^게이츠 등 Globalist 악당들의 정체와 인공 코로나를 퍼뜨리고 신종 백신을 접종시키는 목적(24.8.30보완) 2024.08.25해당카페글 미리보기
센터), FDA(미국 식품의약국) 등과 Global 대형 제약사(Big Pharma)들은 오래 전부터 Deep State 악당들이 장악,관리하고 있고, 이 기구와 조직들을 통해 그들의 사악한 아젠다(Agenda:의제)를 수행하고 있으며 그들이 장악한 전세계(한국 포함) 주류 방송...
-
간추린 뉴스, 2024년 11월 29일 금요일 2024.11.29해당카페글 미리보기
이는 HLB의 리보세라닙과 항서제약의 캄렐리주맙 병용요법으로, 최근 승인 전 단계인 현장실사 결과, 미국 FDA로부터 '보완 사항 없음 판정'을 받았습니다. ● 위기의 반도체 업종을 지원하겠다며 국회에 발의된 반도체특별법이 쟁점인 '주 52시간 예외'를...
-
2024년 서울바이오허브-드레이퍼 디지털헬스 이노베이션 챌린지 참여기업 모집 공고_한국과학기술연구원 2024.11.07해당카페글 미리보기
코리아 글로벌 진출 프로그램 구분 세부내용 P H A S E 1 사업모델분석 · 성장전략 ◾ 글로벌 사업을 위한 모델 수정 및 보완 ◾ FDA 승인 전략 및 BD 전략 수립 ◾ 전략 실행을 위한 조직 역량 보완 IR 고도화 · 투자유치전략 ◾ Financial model 기반으로...
-
11월 19일 시장 주도주 2024.11.19해당카페글 미리보기
11월 19일 시장 주도주 ▶️제약바이오 HLB 간암신약, FDA BIMO 실사 통과...'보완할 사항 없음’ 통보 (https://buly.kr/7bFn9mq) -HLB그룹: HLB, HLB제약, HLB생명과학, HLB글로벌 -제약바이오: 펩트론, 알테오젠 ▶️자율주행 머스크에 날개 달아주는...
-
D-148 9월 24일 상한가 & 특징주 요약 2024.09.24해당카페글 미리보기
모습. HLB, 전일 간암 1차 치료제(리보세라닙,캄렐리주맙 병용요법) FDA에 재승인 서류 제출 공시. 이는 지난 5월16일 FDA로부터 CRL(보완서신) 수령 후 약 4개월 만에 재심사 단계에 진입한 것임. ■ 케이엔제이 16,090원 (+7.63%)155.49억원 규모 장비...